

林忠辉研究员团队在《Nature Chemical Biology》上发表DNA损伤修复分子机制研究成果
生物体包括我们人类每天都会受到的紫外线辐射、自由基和其他化学物质的诱变造成体内遗传物质DNA的损伤,即使没有受到外界环境的影响,细胞自身进行分裂时DNA的复制也会产生错误。而即便如此,为什么绝大部分生物体仍然可以维持其基因组的稳定性而正常生存呢?研究发现,机体内拥有一套保卫系统能够时刻监视并修复着DNA。2015年的诺贝尔化学奖正是颁给了在分子层面上研究这种DNA修复机制的三位科学家。
2019年10月14日,我校beat365林忠辉研究员研究团队在DNA损伤修复分子机制的研究上取得重要进展,论文以“Structural Basis of Sequence-specific Holliday Junction Cleavage by MOC1”为题发表在《Nature Chemical Biology》杂志上。

Holliday junction(HJ)是英国分子生物学家Robin Holliday于1964年首次发现,是在DNA同源重组损伤修复过程中形成的一种十字叉状的DNA连接体,在噬菌体、细菌、真菌、植物乃至动物细胞中均存在。在DNA损伤修复完成后,HJ必须在HJ解离酶的作用下解离,从而促使两条同源DNA双链分开重新成为线性DNA1。MOC1(monokaryotic chloroplast 1)是一个叶绿体特异的HJ解离酶2。
林忠辉研究员研究团队结合了结构生物学、计算生物学和大量的生化数据不仅在原子水平上揭示了HJ解离酶——MOC1的催化机制,而且对RuvC家族悬而未决的底物特异性识别机制也提供了重要的启示。更为重要的是,该研究针对关于核酸酶如何将DNA序列上的微小差异转化成为其催化活性上的巨大不同这一科学问题,创新性地提出了一种双金属离子辅助的DNA序列特异选择性机制。
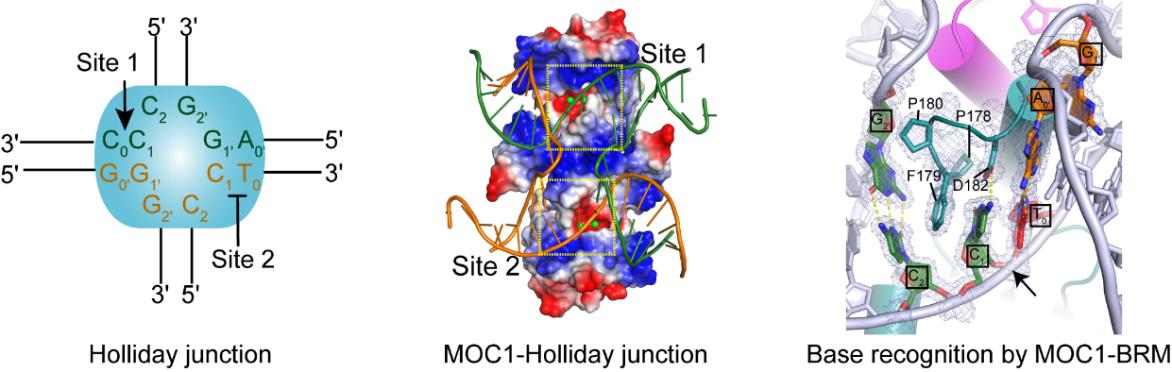
图1.MOC1与HJ的复合物晶体结构
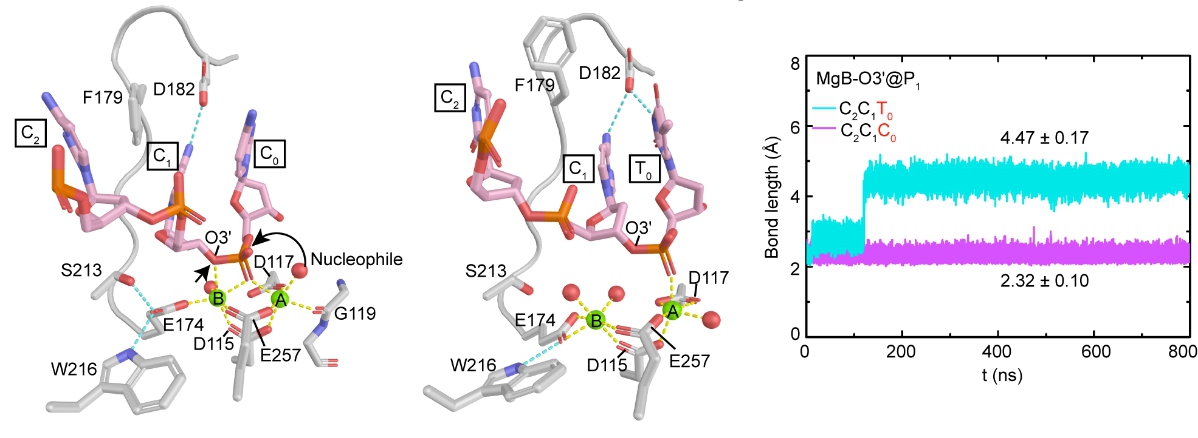
图2.分子动力学模拟揭示DNA底物序列不同引起金属离子配位的变化
我校林忠辉研究员、黄明东教授和李金宇教授为该论文共同通讯作者,博士生林华建、科研助理张丹萍和左柯为共同第一作者,其中林华建由林忠辉教授和黄明东教授共同指导。李金宇教授课题组完成了分子动力学模拟工作。袁彩副教授参与了晶体结构的修正工作。本研究得到了国家自然科学基金、福建省高层次人才引进计划和福建省高校领军人才专项经费资助。上海同步辐射光源(SSRF)BL17U1/BL18U1/BL19U1为本研究提供了重要的技术支持。
论文全文下载地址:http://fmerc.fzu.edu.cn/html/zxdt/xwzx/2019/10/11/40cf7c0a-e3c3-442a-be42-4537276e7c54.html
参考文献:
1. Lilley, D.M. & White, M.F. The junction-resolving enzymes. Nat Rev Mol Cell Biol 2, 433-443 (2001).
2. Kobayashi, Y. et al. Holliday junction resolvases mediate chloroplast nucleoid segregation. Science 356, 631-634 (2017).